日前,材料学院、纤维材料改性国家重点实验室陈志钢教授与朱美芳教授合作开发了一种近红外光驱动的智能纳米胶囊,并联合上海第一人民医院王慧萍医生将其用于动物癌症治疗,取得了重要突破。相关成果以“NIR-laser-switchedIn Vivo Smart Nanocapsules for Synergic Photothermal- and Chemotherapy ofTumors”为题,发表于2016年1月13日出版的《先进材料》(Adv. Mater. 2016, 28,245)上,并被选作这一期的内封面论文(Inside Front Cover)。我校材料学院博士生孟周琪和上海第一人民医院韦芳医生为该论文共同第一作者。《先进材料》为材料学科国际顶尖刊物之一,其最新影响因子为17.493。
众所周知,癌症严重威胁着人类健康。目前,治疗癌症的技术主要包括化学治疗、放射治疗和手术等。其中,化学治疗是癌症治疗的常用手段。理想的化疗要求药物在体内无毒副作用,并且药物到达肿瘤部位时能够保持一定的浓度范围从而产生治疗效果。然而,实际上化疗在杀伤肿瘤细胞的同时,也会杀伤正常组织的细胞,尤其是杀伤人体中生长发育旺盛的血液、淋巴组织细胞等,破坏人体免疫系统,带来严重的副作用。
为了解决这一问题,近期该研究团队开发出一种具有“开关”效应的智能微胶囊(G-CuS-DOX)。将该微胶囊注入到动物体内或直接到肿瘤部位,无光照射时该微胶囊在人体生理温度变化范围(37-42°C)内不会自发释药,避免了化疗的副作用。当微胶囊到达肿瘤部位,用近红外激光精确定位照射肿瘤,肿瘤内的微胶囊会吸收光产生热,导致肿瘤温度升高(~47°C),从而带来光热治疗作用。同时,肿瘤部位的高温(>42°C)促使该部位微胶囊释放药物,而且在体外通过调节激光(功率/辐照时间)可控制肿瘤部位的药物浓度,实现了部位选择性的化学治疗,从而极大提高了药物利用率,减小了药物毒副作用。这种可控的光热/化学联合治疗方式可有效杀死体内癌细胞,抑制肿瘤的转移。经过24天治疗后,可以消除动物肿瘤,其治疗效果优于单一的光热或者化疗效果。因此,该研究对未来恶性肿瘤的无/低副作用治疗具有重要意义。该成果得到国家自然科学基金以及上海市科委基础研究重点科技项目等资助。
(论文链接:http://dx.doi.org/10.1002/adma.201502669)
(封面链接:http://onlinelibrary.wiley.com/doi/10.1002/adma.201670009/full )
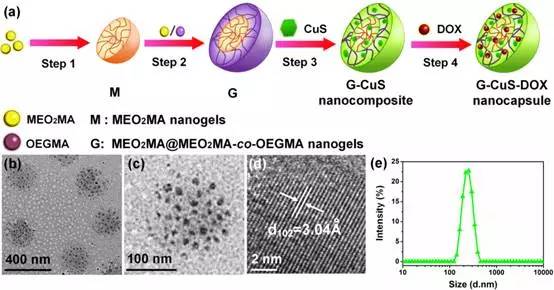
图1:智能纳米胶囊(G-CuS-DOX)的合成过程和形貌

图2:Adv.Mater.当期内封面,展示近红外激光照射下智能纳米胶囊通过光热/化学联合效应杀死癌细胞的过程。
————引自“高分子科学前沿”



