
近日,同济大学化学科学与工程学院王启刚教授团队与同济大学医学院成昱教授合作,在国际top期刊《Angewandte Chemie International Edition》上发表题为《Neutrophils-Inspired Supramolecular Nanogel for Magnetocaloric-Enzymatic Tandem Therapy》的学术论文。
本课题组第一作者:张琦博士生,同济大学为唯一通讯单位。
研究亮点:
1. 首次提出磁热酶串联疗法,即结合程序化的物理激活和生物激发的酶疗法,实现时空控制1O2上调,进行癌症治疗;
2. 通过磷酸酶触发凝胶自组装制备包裹酶的新颖制备方法;
3. 附加的磁导航和成像技术实现主动导航至肿瘤部位,增加肿瘤部位药物的累积。
研究背景:
传统的癌症治疗包括手术、化疗和放疗,有着不可控制的毒副作用,这增加了肿瘤复发率,并导致不良的预后。在肿瘤区域通过生物氧化调节活性氧(ROS)是一种新兴的用于癌症治疗的策略。活性氧(ROS)在细胞内信号转导和细胞命运调控中起着双刃剑的作用。癌细胞中ROS水平升高在很大程度上依赖于抗氧化剂防御系统。因此,适当提高ROS,以精确打破癌细胞脆弱的氧化还原平衡,是有效治疗癌症的关键前提。
外源性ROS可以由物理环境压力(例如紫外线或热暴露)产生,如PDT,SDT,而内源性ROS的主要来源通常来自生物化学酶促氧化,如生物催化芬顿反应。然而,结合物理方法和生物化学方法的优点用于抗癌的方法还没有报道。
事实上,在先天免疫系统中,奇妙的中性粒细胞能够完美地结合外源性炎性细胞因子的活化,通过氧化酶和髓过氧化物酶的分泌来维持持续的生化抗感染和细胞命运调控。在这些过程中,NADPH氧化酶可以产生内源性H2O2或超氧阴离子自由基,并被髓过氧化物酶转化为1O2或次氯酸。这种可激活、可调节的生物催化作用为可调节活性氧升高的肿瘤治疗的物理-生化串联设计提供了很好的启示,即物理刺激可作为短期激活剂,酶可作为生物催化ROS的恒定输出。
成果简介:
有鉴于此,结合PDT和SDT的物理可活化特性以及EDT的有效酶促生物氧化作用,同济大学王启刚教授联合成昱教授课题组提出了一类新型的载有酶的磁性纳米凝胶,MNP-CPO@Nanogels,作为一种可活化和程序控制的嗜中性粒细胞模拟物,通过上调细胞内1O2进行的癌症治疗,称为磁热酶串联疗法(METT)。
总体思路:
串联设计:首先,磁性纳米粒子(MNPs)通过磁热时空控制产生外源性H2O2,然后,氯过氧化物酶(CPO)再通过生物催化作用,将外源H2O2催化生成1O2,用于肿瘤治疗。值得注意的是,自组装凝胶层可为酶促反应提供保护性微环境和底物通道。
纳米凝胶复合物作为MNPs和CPO的结合物,通过程序化的交变磁场诱导热刺激,为控制1O2的生成提供了一种很好的方法。
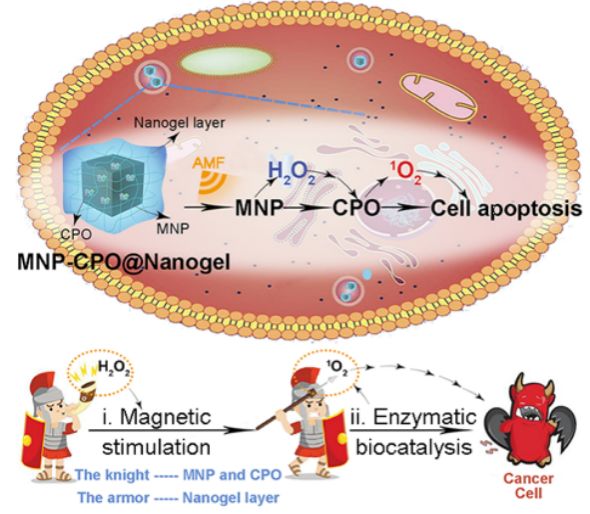
图1. 示意图
小结:
总而言之,受生物抗炎反应性生物催化的启发,首次提出并证明了时空可控的磁热酶串联治疗(METT)策略用于1O2上调的癌症治疗。即载有酶的磁性纳米凝胶可以促进磁热诱导的细胞内ROS的生成以及串联CPO催化的1O2的连续生成。该智能纳米凝胶复合物通过在一个平台上结合程序化的物理激活和生物激发的酶疗法,可以拓宽未来研究人员的抗癌思路。这项工作可以增强工程化的生化反应,使其成为一个串联过程,以上调并产生丰富的1O2用于癌症治疗,这为1O2诱导的肿瘤治疗策略的发展提供启示。
参考文献:
Zhang, Q., Wu, J., Wang, J., Wang, X., Wu, C., Chen, M., Wu, Q., Lesniak, M..S., Mi, Y., Cheng, Y. and Wang, Q. (2019), Neutrophils‐Inspired Supramolecular Nanogel for Magnetocaloric‐Enzymatic Tandem Therapy. Angew. Chem. Int. Ed.
doi:10.1002/anie.201915118
https://doi.org/10.1002/anie.201915118



