前言
肿瘤特异性响应的光诊疗技术有益于实现肿瘤精准治疗。近日,美国国立卫生研究院(NIH)的陈小元教授课题组和中南大学附属第三湘雅医院的王维教授共同合作,巧妙的设计了一种新型的肿瘤微环境特异性响应的光学诊疗典范平台。该肿瘤诊疗一体化平台即通过将有机半导体材料和无机氧化金属团簇进行完美的结合,制备出新型有机-无机杂化纳米材料。并利用肿瘤微环境中的酸性和还原性特性,诱使纳米材料在肿瘤中富集增强并增强其近红外吸收,进而增加了其光声成像的效果。同时,可以在最低副作用的情况下实现肿瘤的光消融。相关工作以题为“Near-Infrared Semiconducting Polymer Brush and pH/GSH responsive Polyoxometalate Cluster Hybrid for Enhanced Tumor Specific Phototheranostics”发表在Angewandte Chemie International Edition(doi.org/10.1002/anie.201808074)上。
研究背景
近年来,光触发的肿瘤诊断和治疗技术作为一种新型非侵袭性的诊疗手段,受到了广泛关注。拥有富电子结构的有机半导体共轭聚合物,极易吸收近红外光,从而实现光能到热能的转化。因此,可作为优异的光声成像造影功能和光热治疗试剂用于癌症诊疗,这也成为最近研究的热点话题。
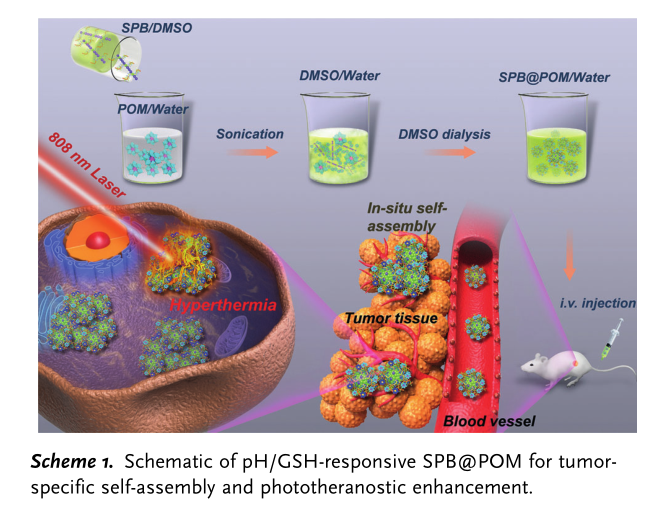
对于半导体共轭聚合物的临床应用,目前仍有许多问题亟待解决。由于半导体共轭聚合物有较强的疏水性能,所以通常需要用两亲性的表面活性剂将其进行包覆,形成水溶性纳米颗粒方可使用。然而,制备所得到的二元性纳米胶束通常容易在体内大量蛋白的存在下,在血液循环中失去其原本的形态并滞留在正常组织中,造成不可避免的副作用。因此,作者从共轭聚合物分子结构的设计出发,制备出两亲性的有机半导体共轭聚合物分子刷,并通过溶液自组装的方法制备出结构稳定的纳米颗粒。
对于纳米材料来说,被动靶向肿瘤通常会致使正常组织对于纳米颗粒的摄入过多,而在光热治疗的过程中,则会导致正常组织过热灼烧的结果。主动靶向的纳米颗粒被证明的确具有提升治疗效果的功效,但是由于纳米颗粒表面修饰的主动靶向制剂通常为多肽和抗体,价格昂贵,且合成复杂。因此,作者提出设想,是否可以通过增强被动靶向的效果从而实现纳米颗粒在肿瘤区域的富集增强。这样不仅可以减少纳米颗粒的用量,而且可以降低光热治疗带来的副作用。
肿瘤微环境相比于正常组织,具有酸性/还原性的特点。钼基金属氧化物团簇(POM)具有酸性/还原性响应型的特点,可以被肿瘤的酸性环境诱导增强富集,并同肿瘤中大量还原性的谷胱甘肽反应,形成自适应电子结构,激活其对近红外光的吸收。然而POM的尺寸很小(只有1纳米左右),在血液流动的过程中很容易被单核吞噬细胞系统所清除,只有通过大剂量的注射才能实现优异的光诊疗效果。为了解决上述这些问题,作者利用了共轭聚合物的强吸收作用以及POM的微环境刺激响应的优势,将其二者巧妙结合,提出了肿瘤精准治疗的新策略。论文的共同第一作者均为NIH博士后:杨震,范文培,唐玮。
全文亮点:
1.首先通过理论计算的指导,制备出具有近红外吸收且和POM具有匹配吸收的半导体共轭聚合物。
2.制备出具有近红外吸收的有机半导体共轭聚合物分子刷,利用其双亲性多功能的分子刷结构,可以和POM螯合并驱动自组装形成纳米颗粒。
3.光诊疗纳米制剂可以实现肿瘤微环境特异性响应,实现肿瘤富集增强和近红外吸收放大。
4.纳米制剂还可以用作多模式成像平台,比如光声成像(PA),正电子扫描成像(PET)。在多模式成像的指导下,进行肿瘤光消融。
来源:研之成理 微信公众号



